Publicidade
SÃO PAULO – Dimas Covas, diretor do Instituto Butantan, afirmou que a CoronaVac, vacina contra Covid-19 produzida pela farmacêutica chinesa Sinovac em parceria com o instituto, pode ser aprovada ainda neste ano pela agência de vigilância sanitária da China.
“É possível que o registro saia muito rapidamente na China, e muito rapidamente significa até o fim do ano”, afirmou Covas. O diretor deu essa estimativa de registro oficial durante uma coletiva realizada nesta quinta-feira (10), no próprio Instituto Butantan.
O diretor estava junto de João Doria, governador do estado de São Paulo, que anunciou o começo da produção da CoronaVac no Butantan. A capacidade de produção seria de um milhão de doses por dia. Doria reiterou que o desejo pela vacina é nacional e que 12 estados, incluindo São Paulo, já formalizaram solicitação para comprar a vacina.
Continua depois da publicidade
Segundo Covas, também já existem negociações em curso para exportar a CoronaVac para países da América Latina. Seriam 40 milhões de doses adicionais para a região. O diretor do Instituto Butantan disse que esteve na Argentina para tratar sobre uma possível remessa de 10 milhões de doses, com fornecimento a partir de janeiro. Também mencionou o interesse do Paraguai, do Peru, do Uruguai, de Honduras e da Organização Pan-Americana da Saúde, que pertence à Organização Mundial da Saúde (OMS).
A CoronaVac é a vacina contra o novo coronavírus promovida pelo Governo de São Paulo, e já aplicada de forma emergencial na própria China. Vale lembrar que o imunizante ainda não conta com o registro oficial da autoridade reguladora brasileira, a Agência Nacional de Vigilância Sanitária (Anvisa). Antes, a vacina precisa apresentar os resultados de eficácia sobre a fase 3 de testes (última antes da aprovação), requisito internacionalmente exigido para que um imunizante possa ser aprovado para distribuição.
Por enquanto, a CoronaVac apenas mostrou resultados satisfatórios sobre as fases 1 e 2 de testes, revelando-se segura e capaz de produzir uma resposta imune do organismo contra o coronavírus Sars-CoV-2 em 97% dos casos, conforme estudo publicado na revista científica “The Lancet”. Mas o diretor do Butantan já afirmou que os estudos sobre eficácia da fase 3 devem ser divulgados no dia 15 de dezembro.
Continua depois da publicidade
Um caminho alternativo para a CoronaVac no Brasil
Segundo Covas, a aprovação pela agência de vigilância sanitária da China “nos leva a uma lei do começo do ano, que diz que é possível a importação e uso de equipamentos e medicamentoso contra a Covid-19.”
O diretor do Instituto Butantan se refere a um caminho alternativo à aprovação da Anvisa que governadores estão propondo, que passa justamente pela validação das vacinas no exterior. A apelidada “Lei Covid” (n° 14.006/de 28 de maio de 2020) permite o uso de uma vacina no Brasil se o imunizante tiver o aval de agências sanitárias de alguns países específicos, sem depender de uma aprovação nacional.
A lei diz que, caso alguma agência regulatória dos EUA, do Japão, da União Europeia ou da China autorize o uso de uma vacina, a Anvisa tem um prazo de 72h para se manifestar sobre a decisão. Caso contrário, o imunizante é aprovado automaticamente.
Continua depois da publicidade
Pode ser o caminho percorrido pela CoronaVac, assim como pela vacina produzida pela farmacêutica Pfizer e pelo laboratório alemão BioNTech. O imunizante Pfizer/BioNTech está próximo de aprovar seu uso emergencial nesta quinta-feira (10) pela FDA, agência regulatória de medicamentos dos Estados Unidos.
Um obstáculo para fazer essa “Lei Covid” valer mesmo é a diferença entre um registro definitivo e uma autorização temporária emergencial de vacina. Segundo Marina Zago, advogada da área de Direito Público e Regulatório do escritório de advocacia Demarest, a lei traz no artigo terceiro, inciso oito, a palavra “registro”, ou seja, a vacina precisa estar registrada em outro país.
“Por definição conceitual, o registro é aquele definitivo do produto. Não podemos confundir registro com autorização temporário emergencial, que subsiste enquanto existe a emergência em saúde pública”, diz Marina. “Na minha interpretação, o produto precisa estar registrado no sentido do registro definitivo. Porém, podemos esperar que haja outras interpretações, que esse registro estaria englobando a autorização temporária emergencial, mas isso não está escrito na lei.”
Também de acordo com Marina, a própria Anvisa pode utilizar o conceito de registro para justificar uma eventual negativa. Seja para aprovar ou negar a autorização da vacina no Brasil, a Anvisa é obrigada a fornecer análises e perícias técnicas que sustentem a aprovação ou desautorização do imunizante, segundo a advogada.
Vale lembrar que a análise do órgão será escrutinada por técnicos independentes, especialistas das aéreas da saúde e do direito e pela própria sociedade civil. “Qualquer decisão destas deve ser respaldada por um laudo técnico e científico, que estará público para a análise de qualquer um que esteja interessado”, explica Marina.
Segundo Marina, a agência brasileira também pode recorrer à aprovação automática, já que a Anvisa é a autoridade máxima no âmbito de saúde no país. “A Anvisa é o nosso órgão competente para avaliar questões de segurança e eficácia e para aprovar ou não qualquer produto de interesse à saúde. Neste caso, as vacinas”, explica Marina.
Continua depois da publicidade
Como é autoridade no assunto, a Anvisa também pode simplesmente suspender qualquer registro de medicamento no país.
“Nada impede a Anvisa de se manifestar após o prazo das 72h e, demonstrando que o imunizante pode trazer algum risco à saúde pública, suspender imediatamente a autorização de importação”, explica a advogada, que esclarece que todas as decisões precisam ser tomadas com base em relatórios e análises técnicas. “Na prática, a Anvisa garante a parte sanitária dos portos e aeroportos no Brasil. Nesse caso, ela simplesmente não permitira a entrada do produto que desautorizou.”
Anvisa teria visto “pontos fora dos padrões” na China
Do outro lado do mundo, a equipe de técnicos da Anvisa teria identificado “pontos fora dos padrões” em sua visita à fabrica da Sinovac na China, de acordo com a revista Veja. A Anvisa teria considerado a fábrica chinesa “moderna”, mas com “questões menores”. Essas falhas seriam relevantes a ponto de precisarem ser corrigidas para que a certificação da CoronaVac saia no Brasil.
Continua depois da publicidade
Ainda segundo a Veja, os pontos incongruentes serão descritos em relatório sobre o laboratório. O documento será enviado ao Instituto Butantan, que então deverá apresentar formalmente esclarecimentos em até cinco dias úteis após o recebimento.
Em resposta à Veja, a Anvisa afirmou que, na reunião de encerramento da inspeção, “é realizado um fechamento, citando os achados da inspeção” e não confirmou os supostos pontos fora dos padrões, citados pela revista. “A comunicação é feita com Instituto Butantan, nos termos formais do processo de inspeção. O tema é prioridade para a Anvisa, estamos atuando focados para favorecer o acesso às vacinas da Covid-19. Por fim, não confirmamos o exposto na reportagem, reconhecemos, apenas, os canais de informações formais com o Instituto Butantan.”
Como está a vacinação no Brasil?
Também nesta quinta-feira (10), a Anvisa aprovou uma proposta que dará autorização temporária de uso emergencial, em caráter experimental, para as vacinas contra a Covid-19. Pelo novo trâmite, empresas que hoje produzem os diversos imunizantes contra o coronavírus poderão fazer um pedido de concessão nesses moldes.
Se autorizadas, as vacinas podem entrar em uso, inclusive nos programas públicos de vacinação, enquanto aguardam o processo de registro final. A Anvisa informou que ainda não recebeu nenhuma demanda por autorização temporária de uso emergencial.
O ministro da Saúde, Eduardo Pazuello, afirmou um dia antes, nesta quarta-feira (9), que a vacinação contra a Covid-19 no Brasil pode começar em dezembro ou no início do ano que vem, entre janeiro e fevereiro.
Pazuello não colocou a CoronaVac entre as entregas já previstas para o início de 2021. O ministro citou 15 milhões de doses da vacina desenvolvida pela farmacêutica AstraZeneca e pela Universidade de Oxford. Mencionou também 500 mil doses iniciais da Pfizer/BioNTech.
Sobre a CoronaVac, Pazuello afirmou: que ainda não tinha o número de disponibilidade para janeiro. Mas afirmou que o governo federal irá comprar “qualquer vacina que estiver registrada na Anvisa, comprovando sua eficácia e segurança”.
O anúncio do plano federal ocorreu após um desentendimento entre Pazuello e João Doria, governador de São Paulo, por conta da CoronaVac. No início desta semana, Doria anunciou que a vacinação em São Paulo começará no dia 25 de janeiro, embora a vacina ainda não tenha sido registrada pela Anvisa.
Na coletiva de quarta-feira, Pazuello afirmou que não há nenhum atrito entre Ministério da Saúde e o Instituto Butantan, ligado ao governo de São Paulo. O ministro considerou a conversa entre ele e o governador João Doria como “polida e cortês”. “Temos um memorando de entendimento em vigor com o Butantan. Nós vamos adquirir as vacinas produzidas que forem registradas. O Butantan é o principal fornecedor de vacinas para o SUS. Não há nenhum tipo de atrito com o Butantan”, afirmou o ministro.
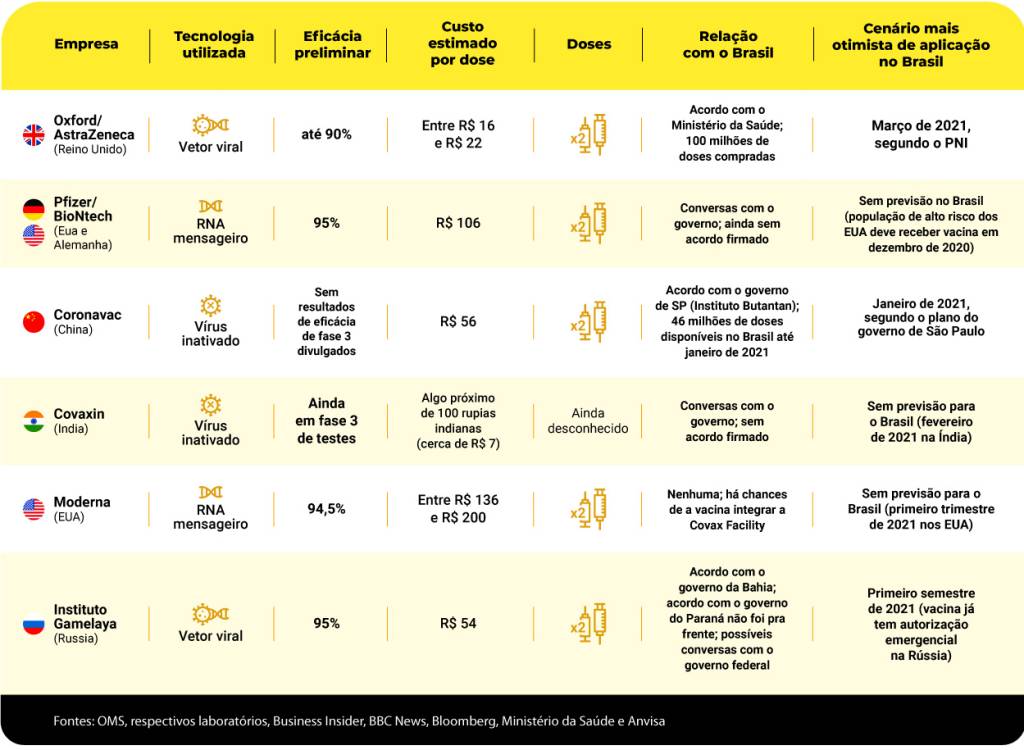
Veja um resumo dos diversos imunizantes testados e produzidos para combater a Covid-19, além de sua relação com o Brasil:
Treinamento gratuito: André Moraes mostra como identificar operações com potencial de rentabilidade na Bolsa em série de 3 lives – assista!
Planilha
Resultados do 3º trimestre

Acesse gratuitamente a planilha secreta do InfoMoney para acompanhar a temporada de balanços. Clique no link abaixo para receber a sua por email.

You must be logged in to post a comment.