Publicidade
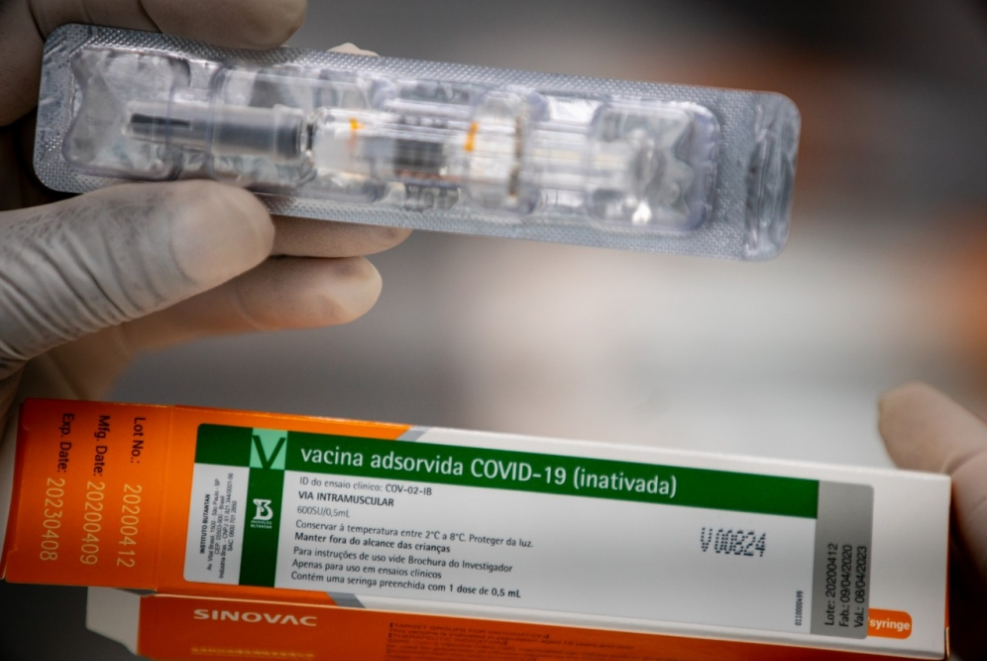
A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou hoje (28) a importação, em caráter excepcional, da vacina CoronaVac na forma de produto intermediário, ou seja, não envasado. O insumo é fabricado pela farmacêutica chinesa Sinovac em parceria com o Instituto Butantan.

Por meio de nota, a agência informou que a solicitação de importação da matéria-prima para fabricação da vacina foi feita pelo próprio Butantan. A CoronaVac ainda não tem registro no Brasil. “Os estudos ainda estão em andamento e não existe previsão de data para a vacinação”, ressaltou a Anvisa.
Testes clínicos
A CoronaVac está na terceira fase de testes clínicos. Como a Anvisa já havia aprovado a ampliação do estudo para 13 mil voluntários, o governo paulista decidiu ampliar o número de centros de pesquisa. Na fase atual, metade dos participantes recebe a vacina e a outra metade, placebo.
Ebook Gratuito
Como analisar ações
Cadastre-se e receba um ebook que explica o que todo investidor precisa saber para fazer suas próprias análises
Ao informar os dados, você concorda com a nossa Política de Privacidade.
Caso a última etapa de testes comprove a eficácia da vacina, o acordo entre a Sinovac e o Butantan prevê a transferência de tecnologia para produção do imunizante no Brasil.
Eficácia
Para comprovar a eficácia da vacina, é preciso que pelo menos 61 participantes do estudo, que tomaram placebo, sejam contaminados pelo vírus. A partir dessa amostragem, é feita então uma comparação com o total dos que receberam a vacina e, eventualmente, também tiveram diagnóstico positivo da covid-19.
Se o imunizante atingir os índices necessários de eficácia e segurança, será submetido a uma avaliação da Anvisa para registro e só então a vacina estaria liberada para aplicação na população.